宫颈癌作为妇科最常见的恶性肿瘤之一,一直以来严重威胁着广大女性的健康。同时,宫颈癌也是目前唯一病因明确且能通过疫苗接种、早期发现和治疗而消除的癌症。因此,定期筛查、及早诊断对于宫颈癌的防治十分关键。
近日,美国阴道镜和子宫颈病理学会(ASCCP)重磅发布了第一个创新的“持久指南”(Enduring Guideline)——《使用 p16/Ki67 双染检测来管理HPV检测阳性个体的推荐》(《Recommendations for Use of p16/Ki67 Dual Stain for Management of Individuals Testing Positive for Human Papillomavirus》)(以下简称“2024双染指南”)。该指南是由ASCCP联合全美其他19个协会制定,旨在将新的技术和方法、以及新的数据纳入到现有的指南框架,这也是全球首个推荐p16/Ki-67细胞学双染检测(罗氏诊断CINtec® PLUS)用于优化宫颈癌初筛结果异常后的分流及管理的权威指南。
p16/Ki-67 细胞学双染检测是一种免疫细胞化学检测方法,用于同时定性检测宫颈细胞学制片中的p16和Ki-67蛋白。在正常细胞中,p16与Ki-67不会同时出现;当两者同时表达是细胞周期失调的一个明确指标,可提示与持续性HPV感染相关的细胞致癌性转化。p16/Ki-67免疫细胞学双染检测不依赖形态学,易于掌握。该检测与细胞学检测相比,能增加诊断宫颈高级别上皮内病变(CIN2+)的灵敏性,降低漏诊率,减少延误诊断的同时减少阴道镜转诊的数量,对于宫颈癌初筛异常后的分流及管理有重要的临床参考价值。p16/Ki-67免疫细胞学双染检测技术问世10多年来,在全球范围积累了大量的临床研究以及长期的随访数据,此次该技术被纳入2024双染指南也是基于其充分的循证医学证据。
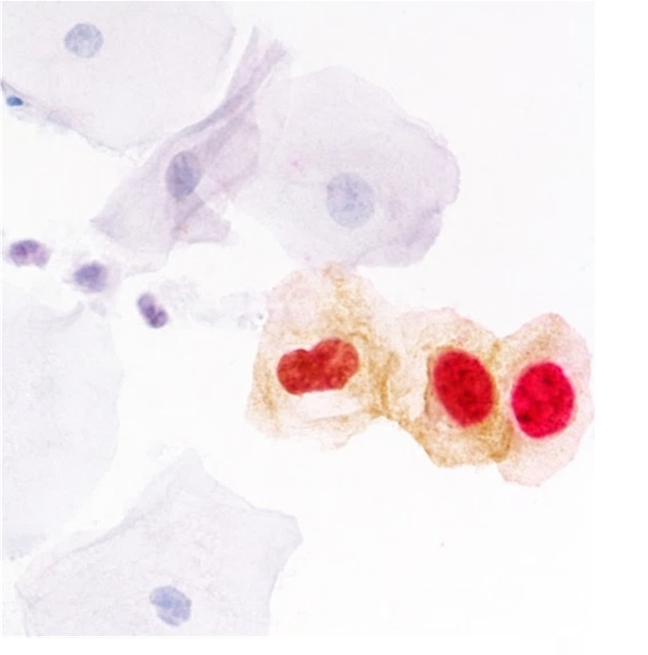
图:双染阳性细胞,p16阳性表现为胞质呈棕色染色;Ki-67阳性表现为胞核呈红色染色。
2024双染指南关键要点
ASCCP此次发布的2024双染指南,明确了3个关键要点:
1. 该指南推荐仅限于FDA批准的p16/Ki-67双染细胞学检测(目前罗氏CINtec® PLUS是唯一FDA批准的双染细胞学检测),其他未经FDA批准的双染检测试剂性能可能不相似,不能假设指南推荐具有普遍性;
2. 这些推荐仅限于无症状的女性,有症状女性(比如异常阴道出血或异常子宫出血)参考其他指南推荐;
3. 指南无法对所有双染相关的应用场景进行推荐。
2024双染指南通过资源利用率模型,评价p16/Ki-67双染检测的效能
基于凯撒人群(KPNC)的研究结果,2024双染指南建立了100,000人的筛查和3年随访的模型,比较了p16/Ki-67双染检测和细胞学在不同临床场景下的资源利用效能,包括:①阴道镜转诊数量;②门诊数量;③检测数量;④诊断发现CIN3+的时间(年)。
2024双染指南对p16/Ki-67双染检测法进行了如下五种情况的推荐:
双染检测法可用于高危HPV(不分型)阳性患者的分流,并根据风险进行管理(推荐等级为A-II);资源利用率模型显示:双染检测比细胞学减少了12%的阴道镜数量,同时减少了40%的CIN3+延误诊断时间。
双染检测法可用于高危HPV部分分型(HPV 16型、18型以及其他12种亚型检测)初筛阳性人群的分流,并根据风险进行管理(推荐等级为A-II);资源利用率模型显示:双染检测比细胞学减少了11%的阴道镜数量,同时减少了22%的CIN3+延误诊断时间。
双染检测法还可以用于HPV和细胞学联合筛查中,对高危HPV(不分型)阳性或其他12种高危HPV亚型阳性,且细胞学结果为NILM、ASC-US或LSIL人群进行分流,并根据风险进行管理(推荐等级为A-II);资源利用率模型显示:双染比细胞学,虽然增加了5.7%的检测数量,但减少了11%的阴道镜数量,同时减少了64%的CIN3+延误诊断时间。
当筛查结果异常、阴道镜检查后或治疗后对患者进行随访时,也可以根据指南应用双染检测法(推荐等级为B-II)。
当双染检测法得到的结果为“不满意”,则推荐重新采样(推荐等级为C-III)。
ATHENA研究是美国本土最大型前瞻性多中心宫颈癌筛查临床试验,旨在优化宫颈癌初筛的策略,共纳入了46,887名女性,研究显示HPV单独初筛优于细胞学单独初筛以及和联合筛查效能相似。基于这个里程碑研究,美国食品药品监督管理局(FDA)于2014年批准罗氏的cobas HPV作为首个可用于HPV单独初筛的产品,紧随其后2015年ASCCP联合多个协会制定了过渡期指南,推荐HPV单独初筛用于宫颈癌筛查。目前全球越来越多的国家和地区都开始或计划采用HPV单独初筛的策略。
IMPACT研究是罗氏在美国启动的另一个前瞻性多中心临床研究,旨在改善宫颈癌初筛后的分流策略,共纳入了35,263名女性。研究显示,p16/Ki-67细胞学双染检测在HPV单独初筛阳性后的分流方面优于细胞学分流。2020年FDA批准罗氏诊断CINtec® PLUS作为首个p16/Ki-67细胞学双染检测,用于cobas HPV 阳性后的分流。
此次ASCCP发布的全球首个双染指南,正是基于CINtec® PLUS在美国多个临床研究数据、以及FDA的批准而制定的临床推荐,有助于进一步优化宫颈癌筛查分流管理,让更多患者从中获益,为加速消除宫颈癌全球战略提供支持。
引用文献:
Clarke MA, Wentzensen N, Perkins RB, Garcia F, Arrindell D, Chelmow D, Cheung LC, Darragh TM, Egemen D, Guido R, Huh W, Locke A, Lorey TS, Nayar R, Risley C, Saslow D, Smith RA, Unger ER, Massad LS; Enduring Consensus Cervical Cancer Screening and Management Guidelines Committee. Recommendations for Use of p16/Ki67 Dual Stain for Management of Individuals Testing Positive for Human Papillomavirus. J Low Genit Tract Dis. 2024 Mar 6.
